研究内容
RBの新規機能
今、なぜ、RBか?
ヒトRBがん抑制遺伝子は、いまから25年も前に、網膜芽細胞腫を発症する家系の遺伝子連鎖解析によって発見されました。遺伝子の働きが欠失することによって悪性腫瘍が誘導される。つまり、正常のRB遺伝子は、がんの発生を抑制していることがわかったわけです。そのような遺伝子が存在するであろうことは、計算上予想されていたわけですが、具体的な遺伝子が同定されたのは、はじめてでした。その後、この遺伝子を欠失するマウスが作られ、実際に、様々な臓器のがんを生じることが確かめられました。ヒトでは、この遺伝子の突然変異や欠失は、上記の網膜芽細胞腫に加え、骨肉腫、肺小細胞がんなど、限られた種類の腫瘍で観察されます。ところが、この遺伝子からつくられる蛋白質の不活性化あるいはこの蛋白質の働きを上流から制御する遺伝子群(RB経路)の異常ということを含めると、RBの働きは、大半のがんで不活性化しています。また、不活性化のタイミングは、がんが発生するときよりも、いったん出来たがんが悪性進展する過程においてであることが多いことがわかってきました。
RB蛋白質の正常細胞における第一義的な働きは、細胞周期の制御であると考えられています。細胞外から受容体を経て伝達される増殖シグナルは、そのほとんどすべてが、D型サイクリン群の転写を促します。D型サイクリン群は、サイクリン依存的キナーゼ(CDK)群と複合体を形成し、RB蛋白質のリン酸化を行います。E2F転写因子群のいくつかは、RB蛋白質と転写抑制性の複合体を形成します。ところが、RB蛋白質のリン酸化の進行は、この複合体からE2Fを乖離させ、乖離したE2Fは、様々なサイクリン群など標的遺伝子の転写を促進します。この結果、細胞周期、DNA合成、DNA複製のライセンシング制御等が進行します。
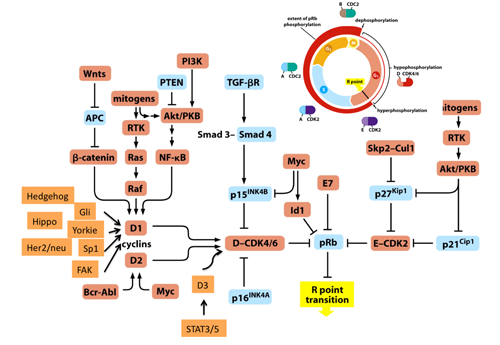
図1 The Biology of Cancer (© Garland Science 2007)を改変。
ほとんどすべての細胞増殖シグナルが、RB蛋白質に流れ込む。
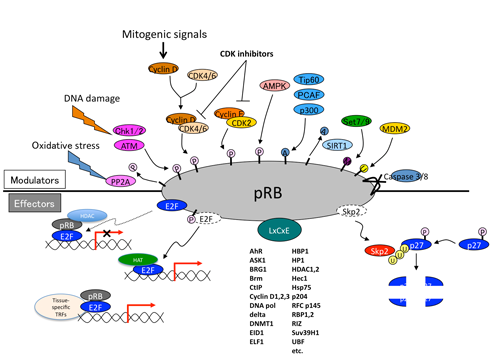
図2 RB蛋白質の上流シグナルと様々なエフェクター分子。
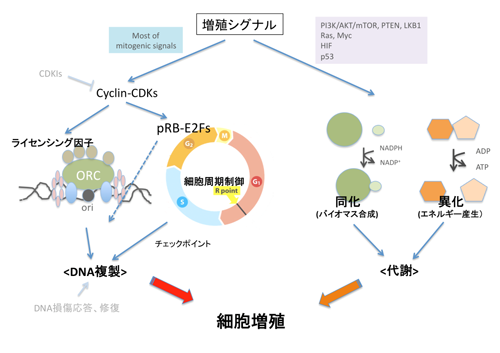
図3 細胞増殖シグナルは、細胞周期と細胞増殖のために必要な代謝活動の両方を制御する。
ところが、pRBと複合体を形成するE2F-1~3は、細胞の置かれたコンテクストによっても変化する多様な遺伝子群を標的とします。これらの遺伝子には、細胞周期のみならず、細胞の分化や代謝を制御するものが多数含まれます。さらには、図に示したように、pRBは、LxCxEモチーフという特徴的な配列を持った蛋白質群と結合します。これらの蛋白質群には、クロマチンの構造や化学的修飾状況を制御したり、転写を制御したりと、様々な働きを持つものが含まれますが、各々の複合体機能の理解はまだ進んでいません。また、最近では、pRBが、別のがん抑制遺伝子産物p27の分解制御に関わることも明らかになりました。この様に、pRBの下流は、まだ謎が多いのです。一方、サイクリン・CDK複合体のほかに、pRBの働きを上流から制御する分子もどんどん同定されています。よく知られたリン酸化だけでなく、アセチル化、メチル化、ユビキチン化、SUMO化あるいは、カスペースによる分解と、多様な機能修飾パスウェイが存在します。このように、pRBは、多様なシグナルをこれまた多様なシグナルへと変換する「アダプター蛋白質」ととらえられています。こうなると、pRBの働きが、古典的な細胞周期あるいは分化の制御のみであると考えるのは難しくなります。たぶん、もっと沢山の、そして、もっと重要な働きを持つはずであると考えるわけです。
RBの働きを探索するシンプルモデルへ
PI挨拶に書いた、線虫研究に端を発した、Rb-Rasの新しい遺伝学的関係の発見は、それまでがん原性Rasの下流遺伝子を中心に研究を進めていた私にとって、ちょっと驚きでした。野生型のRasにも、特異的な役割があり、制御系が存在する。最初にこの視点を私に与えてくれたのは、ハーバード大学ダナ・ファーバー研究所時代の恩師、Mark Ewen博士です。このRbの働きは、それまでに得られていた知見によっては、説明のつかないものでした。私は、まず、Ewen研において、ほ乳類においてもRb-Rasの新しい遺伝学的関係が成立することを複合遺伝子ノックアウトマウスという手法を用いて証明しました。日本に帰ってからは、メカニズムの解明に腐心し、一定の答えを得るに至りました。それは、RBが、Ras蛋白質の成熟に必要な、ファルネシル化とゲラニルゲラニル化という反応をこれらに必要な酵素をコードする遺伝子の転写段階で制御するというものです。これらの反応は、Rasの成熟のみに必要なのではなく、small GTPase を多く含む、CAAXモチーフを持った蛋白質群の成熟にも必要です。さらに、Rbは、ファルネシル化とゲラニルゲラニル化を内包するメバロン酸経路という代謝経路をひろく制御することがわかってきました。この発見が次のブレークスルーにつながりました。このような新規機能がわかったのは、RBの細胞周期への影響を考慮しなくても済むような、そして、なるべくシンプルな実験系を用い、マイクロアレー法など、実験者の思い入れによるバイアスが最小になる手法を用いたことが幸いしたのだと思います。この新規機能の生物学的な意義の探索を含め、RBの未知の機能を明らかにするため、様々なコンテクストにおいてRb機能を反映するシンプル実験系をいくつも作製しています。
RBのエピジェネティック機能
RBのもっとも主要なパートナーは、E2F転写因子群と言われています。一方、LxCxEモチーフという特徴的な配列を持つ蛋白質群がpRBに直接に結合することが知られます(図参照)。これらは、D型サイクリンであったり、クロマチン修飾因子であったり、多様なカテゴリーに属します。我々は、複合変異マウスの解析によって、RBが、これらのパートナーのうちDNMT1(DNA methyltransferase 1)とHDAC1を含む転写抑制性複合体の安定化に寄与することを明らかにしました。この働きには、RbがATMというDNA損傷応答のマスターレギュレーターの活性を様々なパスウェイによって制御することと、活性化ATMが、DNMT1に直接に結合してそのユビキチン化を制御するという二つの機構が含まれています。つまり、RBの不活性化は、ATM依存的にDNMT1を不安定化させ、よって、ゲノムのDNAメチル化パターンに変化をもたらします。DNAメチル化パターン異常、とりわけ、INK4a等がん抑制遺伝子プロモーター領域の高メチル化は、がん細胞の代表的な特徴です。このような現象は、がん細胞へのトランスフォーメーション、あるいは、がん幹細胞様の遺伝子発現プロファイルを安定的に維持するためのエピジェネティック変化の本態をなしている可能性があります。RBのエピジェネティック機構は、これまであまりしっかりしたエビデンスが出てきていなかったのですが、近年、iPS細胞誘導やがんの悪性進展にとって、RBのエピジェネティック機構が抑制されることが重要であるという知見がもたらされています。がんの悪性進展におけるRBの不活性化によるエピジェネティック変化は、がんの悪性形質を制御するためのよい標的となるかもしれません。
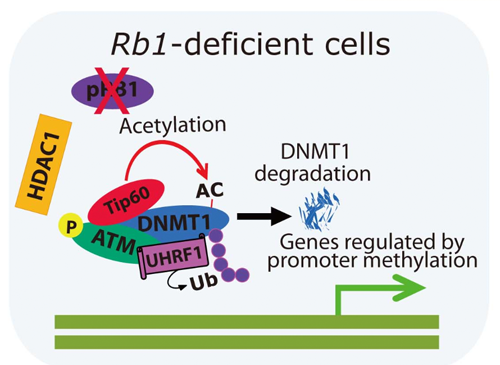
図4 RB蛋白質のエピジェネティク機能のひとつ。
がん特異的代謝 – RBのメタボリック機能
いろいろな代謝経路が存在するなか、Rbは、メバロン酸経路を特異的に制御します。単一の遺伝子が、沢山の酵素が連続して制御する代謝経路を広範囲に制御するというのは、いまでは、珍しいこととは考えられていません。そのことを解説する前に、がん細胞のなかの代謝は、正常の細胞とどう違うのかを押さえておきましょう。
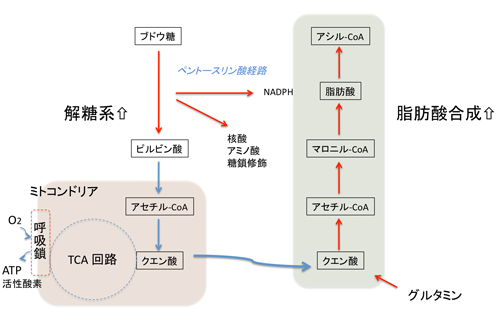
図5 がん細胞特異的な代謝様態。
ほ乳類の細胞は、酸素を用い、酸化的リン酸化を行うことによって、ATPすなわちエネルギーを産生します。酸素が少なくなると、糖の利用(解糖)を亢進し、酸化的リン酸化以外の代謝経路によってエネルギーを産生します。ところが、がん細胞、あるいは、盛んな増殖期にある正常細胞は、酸素が豊富に存在するにもかかわらず、解糖に偏った代謝様態を示します。どんな状態でも常に解糖的になっているのががん細胞の代謝の特徴のひとつで、もう一つは、脂質合成の亢進です。解糖系とそこから分岐するペントースリン酸化経路の亢進は、脂肪酸合成に必要なエネルギーすなわちNADPHの産生を増加させます。一方、TCA回路の供給からだけでは需要に追いつかなくなった脂質の炭素骨格はグルタミンの分解によって供給されます。よって、がん細胞では、グルタミンの取り込みも増加します。がん細胞が、このような特異な代謝様態を示す理由は、細胞の自己複製に必要なバイオマス(脂質、核酸、蛋白質)の倍化のために、さらには、細胞の自己複製の強力な阻害因子である活性酸素(ROS)の産生を最小限に抑えるために、TCA回路を使わずに、NADPHの産生を亢進させることが有利であることなどがあげられます。
がん遺伝子あるいはがん抑制遺伝子によって制御される増殖シグナルは、DNAの複製とそのコントローラーとしての細胞周期の制御が主要な役割であると思われてきました。しかし、近年、これらのシグナルが、様々な代謝経路を制御することによって、バイオマスの制御にも関与することがわかってきました。シグナルの種類ごとに、標的とする代謝経路に一定の傾向があります。例えば、Rbと並ぶがん抑制遺伝子の雄p53は、解糖系、グルタミン酸代謝、TCAサイクル、ROS産生を、Rasは、ピルビン酸のミトコンドリアへの取り込み、解糖、非酸化的ペントースリン酸経路、ヘキソースアミン合成、リーボス合成を、Mycは、グルタミン代謝、mTORC1複合体は、解糖、酸化的ペントースリン酸経路、脂質合成を、PTENは、解糖、酸化的リン酸化という風にです。
現在までに、我々は、Rbが、メバロン酸経路に加え、脂肪酸生合成経路などいくつかの興味深い代謝経路を制御することを明らかにしつつあります。Rbが、これらの長大な代謝経路を制御するのは、脂肪酸合成とメバロン酸経路のマスターレギュレーターであるSREBP転写因子群とRbの間に、深い関係が存在するからだと考えて研究を進めています。SREBPはまた変異p53による活性制御も受けますので、Rbとp53経路の新しいノードになる分子と考えています。さらに、Rbは、ミトコンドリア機能を司る遺伝子群の発現や、オートファジー(あるいはmitophagy)を制御することによって、ミトコンドリアの機能やコピー数を制御すると考えています。p53とpRBの両方が不活性化することは、ヒトがんにおいて頻繁に観測されます。従来これらのがん抑制遺伝子は、細胞死(アポトーシス)の制御に於いて協調すると考えられていましたが、炭素源やエネルギー(NADPH)のやりとりを介する解糖系と脂肪酸合成のカップリングにおいても協調関係にあると考えられます。現在、細胞やマウスのレベルでそのことを確かめつつあります。
がん化した細胞において、代謝様態が正常細胞とは全くかわってしまうことをメタボリック・リプログラミングと呼んでいます。この機構の根底には、がん遺伝子やがん抑制遺伝子産物の不可逆的な変化があると考えています。また、Rbのような細胞周期の制御因子が代謝制御にも同時に関わることは、DNA複製と細胞のバイオマス倍化のタイミングを正確に同調させるためには大変に有利な機構でしょう。それからもうひとつ重要なことは、従来の抗がん剤は、DNA複製を、分子標的薬は、細胞増殖シグナルを標的にしたわけですが、がん特異的な代謝異常の全容が明らかになれば、代謝制御によるがん治療を目指すことが可能になるでしょう。実際に、経口糖尿病治療薬であるメトフォルミンや高脂血症の治療に使用されるスタチン類には、非常に有意ながん予防効果があることが報告されています。さらには、がんに罹患したあとでさえも食事・運動療法が有効であることが示されています。私たちは、このような見地から、新しいカテゴリーのがん治療薬を見つけることを目指しています。
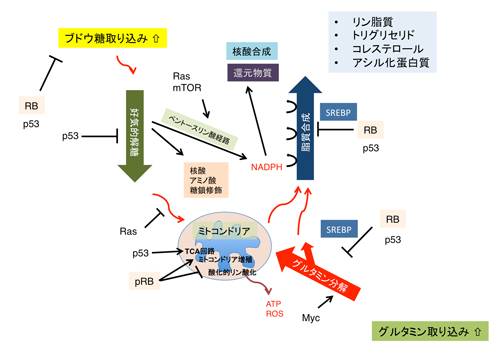
図6 がん遺伝子やがん抑制遺伝子の産物が細胞の代謝を制御するメカニズム。
インビトロがん幹細胞モデル
がん幹細胞とは?
手術あるいは化学療法後のがんの再発の機序を大変うまく説明するのが、がん幹細胞仮説です。これが仮説なのは、がん幹細胞というものが、ある定義を満たすことによって規定されるからです。アメリカがん学会の2006年の総会において提案されたがん幹細胞の定義は、① 腫瘍内の亜集団をなす ②自己複製能をもつ ③ 多分化能を持つ ④ 腫瘍形成能をもつ、という4点です。より実験的な言い方で定義し直すと、① がん細胞集団のうち特定の集団が、免疫不全マウスに腫瘍を作る、 ② 腫瘍形成能をもつ細胞集団は、表面マーカーの発現によりおおよそ区別できる、 ③ 腫瘍形成能をもつ細胞集団から、腫瘍をつくる細胞とそうでない細胞を再構築できる、ということになります。もともとは、表面抗原をたよりに急性骨髄性白血病細胞をいくつかのグループに分けたところ、放射線照射した免疫不全マウスにおいて白血病を再構成できるのは、造血幹細胞にちかい表面抗原の発現パターンを持ったものであったという発見が、がん幹細胞という概念の再認識につながりました。Dick博士らによるこの報告は、白血病は造血幹細胞の異常であると結論づけています。その後、固型腫瘍においても、組織幹細胞と似たプロファイルをもつ細胞亜集団において旺盛な腫瘍原性と多分化能が認められるということが観察されました。ただし、がん幹細胞仮説とは、がんが組織幹細胞に由来するから、がんにも幹細胞があるんだ(がん化幹細胞)ということではありません。がん細胞社会のなかの多層性・多様性を組織幹細胞—分化細胞のヒエラルキーに喩えているだけであり、私は、がん幹細胞という名前は若干ミスリーディングかもしれないとも思います。むしろ、「幹がん細胞」(がん細胞の幹)という風に呼ぶ方が誤解を招かないかもしれません。
がん幹細胞の概念を理解するには、図に示した、ハエとハチの対比がわかりやすいです。ハエは、どの娘ハエも卵を産むことができる、つまり、すべての娘ハエに増殖する能力が与えられています。対して、ハチは、女王蜂にしか、産卵は許されません。子蜂の大半は働き蜂になります。しかし、ごく一部が、女王蜂となり、子孫を残すことによって、ハチ社会は綿々と維持されます。がんの社会は、これまでハエの社会の様であると考えられていましたが、そうではなくて、むしろ、ハチの社会に似ている。つまり、永久にがん細胞を供給する細胞というのは、ごく限られた細胞集団(がん幹細胞=女王蜂)であって、腫瘍の大半を占めるのは、永久には分裂することのない細胞集団(非がん幹細胞=働き蜂)であるという考え方です。これまでのがん治療薬の開発は、腫瘍径の縮小であるとか、腫瘍の大半を占める働き蜂に対する効果を指標にしており、女王蜂に対する効果を想定しておらず、よって、討ち漏らした女王蜂が、ある日、全く違う場所で巣を作る(転移・再発)ということが起きると考えられます。驚くべきことに、女王蜂には、DNAに傷をつけるような従来の抗がん剤を細胞外にくみ出す、ポンプも備わっていることもわかってきました。これは、組織幹細胞や胚性幹細胞と似ています。これらはDNA損傷を受けないように、あらゆる備えを持っています。しかし、女王蜂を一目見て働き蜂と区別できるかというと、表面マーカーの研究の成果を踏まえると、ぼやっーと区別ができるとは考えられますが、がん幹細胞だから姿も立ち居振る舞いも組織幹細胞に似ていると考えるのは、楽観的すぎます。がん化は、組織幹細胞から機能細胞へと分化していくステージのあらゆる段階で起き得ることですし、がん幹細胞様の細胞集団の登場は、悪性進展に伴う獲得形質ともとらえるべきでありますから、由来細胞の形質をいつまでも引きずるというのは、考えにくいのです。実際、がんでは、ハチの世界と違って、働き蜂から女王蜂が産まれるばあいがあるようです。つまり、がん幹細胞と非がん幹細胞は、流動的に入れ替わっている。がん幹細胞として一生運命づけられた細胞がいるということではないようです。あらためて、がんとは恐ろしい相手であると感じます。同時に、ここには、がん幹細胞を数次にわたって枯渇させれば、あるいは、長期にわたって、その働きを押さえ込むことが可能になれば、がんを克服することができるという楽観論が生まれる余地もあります。では、がん幹細胞と非がん幹細胞を隔てるメカニズムはなにかという問題は、それは、まさに、我々を含め、沢山の研究者が解こうとしている大問題です。その謎を解くために、私たちは、思いっきりシンプルながん幹細胞モデルを作ろうと試みました。
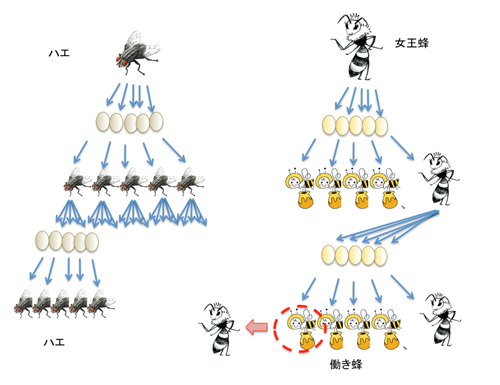
図7 がん幹細胞とは? ハエとハチ。
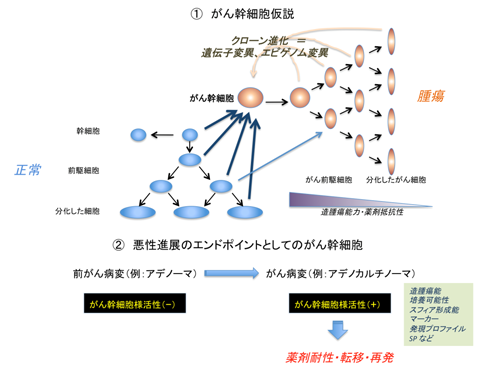
図8 がん幹細胞仮説とは?
インビトロがん幹細胞モデル
患者さんのがんは、ヒトがんそのものでありますから、そこから細胞を頂戴して解析することは、非常に重要な研究です。しかし、ヒトがんは患者さんごとに個性が異なり、かつ、どういう道筋をたどってがんが生じたかというのは、がんゲノムやエピゲノムに刻まれた数々の変異・異常から推測するしかありません。細胞表面(CD)マーカーを頼りにがん幹細胞としての挙動の旺盛な細胞集団を濃縮することが可能ですが、安定的に形質を維持することが困難である上に、どうやってがん幹細胞になったかは実際にはわからないので、解析実験を行う上で必須になる正確なコントロール細胞を手にすることが難しいのです。遺伝学的に均整なマウスを使って、安定的で行き届いたコントロール実験が可能な系を手にすることの方が、早く答えに到達できるかもしれません。このような考えに基づき、我々は、できるだけ少ない組み合わせの遺伝子の変異に依存し、できるだけ単純な実験系に於いて、がん幹細胞様の挙動が発現される系を作製しつつあります。上皮性のがんとがん幹細胞の間には、上皮間葉転換というややこしい問題もありますので、できるだけほかのことを考慮しなくてよいように、現在のところは、上皮由来ということにもあまりこだわらすに、とにかく、スイッチ一つでがん幹細胞様の細胞集団が出現する系を作っています。表面マーカーをもとにグループ分けされた細胞集同士の比較は、表面マーカーががん幹細胞としての振る舞いのドライビングフォースと働くわけではないので、そこから得られる情報には、おおくのノイズが混ざると考えられます。一方、スイッチ一つで誘導された細胞集団と元の細胞集団とを、比較的フェアーな条件(培養条件がまったくいっしょであるとか)において比較することができれば、そこには、低ノイズかつ意味の濃い(特異性の高い)情報が出現すると考えました。さらには、比較によって差違を検出した因子がスイッチとなった遺伝子の標的であれば話は早くなります。このような研究では、実験系のシンプルさが、一番大事です。
我々は、現在、RB複合変異マウス由来細胞を中心に、様々なインビトロがん幹細胞モデルを作製しています。誘導がん幹細胞とその理想的なコントロール細胞を、マイクロアレー法、トランスクリプトーム解析、エピジェネティック解析、メタボローム解析、薬剤スクリーニング等の手法を用いて比較しています。ただいまのところ、がん幹細胞とそうでない細胞の間には、とくに、代謝様態の点で、決定的な違いがあることを見いだしつつあります。がん幹細胞もまた、特異的なメタボリック・リプログラミングを起こしているらしいのです。この研究を推進することによって、我々は、がんの再発・転移のあらたな制御法の開発を目指しています。このあたりは、私たちが現在もっとも力を入れて研究している課題ですので、今後、研究の進展にあわせて、随時本稿に加筆する予定です。